Tumortherapie
Mit anti-IGF1-R-Antikörper funktionalisierte Liposomen zur Behandlung endokrinerTumoren
In der Arbeitsgruppe von Prof. Dr. Regine Süss werden in Zusammenarbeit mit der Abteilung Endokrinologie des Universitätsklinikums München (Prof. Dr. med. Felix Beuschlein, Dr. Constanze Hantel) neuartige Therapiekonzepte zur Behandlung von Nebennierenkarzinomen und gastrointestinalen Tumoren erarbeitet (Dissertationen Dr. Andreas Fritze, Dr. Felicitas Lewrick, Judith Jakoby).
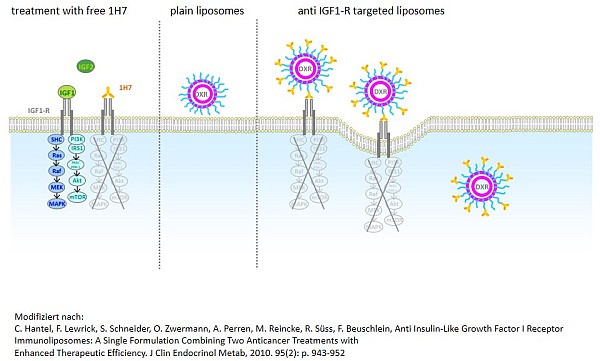
Es wurden mittels aktiv adressierter Liposomen bereits verschiedene Zielstrukturen auf endokrinen Tumoren wie der ACTH-Rezeptor, der SRIF-Rezeptor, Typ 2 und der IGF1-Rezeptor angesteuert. Als therapeutisch sehr effizient stellte sich hierbei in in-vivo-Versuchen eine mit einem anti-IGF1-Rezeptor-Antikörper funktionalisierte und mit Doxorubicin beladene liposomale Präparation heraus. Bei dieser Formulierung dient der Ligand nicht nur als Homing Device, sondern ist gleichzeitig ein hormonelles Therapeutikum. Für solche mit einem anti-IGF1-Rezeptor-Antikörper funktionalisierten Liposomen konnte bereits ein supra-additiver Effekt der beiden Wirkstoffe nach Einmalgabe in vivo gezeigt werden.
Nun soll in weitergehenden Untersuchungen der Aufnahmemechanismus sowie die therapeutische Effizienz dieser Zubereitungen bei Mehrfachgabe und in individualisierten Tumormodellen analysiert werden. Darüber hinaus weisen vorläufige Forschungsergebnisse darauf hin, dass diese Zubereitung auch für andere Tumorentitäten ein wirkungsvolles Therapieregime darstellen könnte und somit für einen breiten Anwendungsbereich etabliert werden könnte.
Förderung
Das Projekt wird seit 2012 durch die Dr. Mildred Scheel Stiftung für Krebsforschung gefördert.
Lewrick F, Süss R: Remote loading of anthracyclines into liposomes, Methods Mol. Biol. 605, 139-145, 2010. [zum Originalartikel]
Hantel C, Lewrick F, Schneider S, Zwermann O, Perren A, Reincke M, Süss R, Beuschlein F: Anti insulin-like growth factor I receptor immunoliposomes: A single formulation combining two anticancer treatments with enhanced therapeutic efficiency, J. Clin. Endocr. Metab. 95, 943-952, 2010. [zum Originalartikel]
Fritze A, Hens F, Kimpfler A, Schubert R, Peschka-Süss R: Remote loading of doxorubicin into liposomes driven by a transmembrane phosphate gradient, Biochim. Biophys. Acta - Biomembranes 1758, 1633-1640, 2006. [zum Originalartikel]
Mit anti-IGF1-R-Antikörpern funktionalisierte Liposomen zur Behandlung des Ewing-Sarkoms
Aufgrund der hohen Sensibilität des Ewing-Sarkoms gegenüber Doxorubicin und anti-IGF1-R-Antikörpern stellen mit dem anti-IGF1-R-Antikörper funktionalisierte Formulierungen eine sehr vielversprechende Behandlungsstrategie für diese Erkrankung dar. Deshalb sollen sie in Zusammenarbeit mit Prof. Dr. Udo Kontny vom Zentrum für pädiatrische Hämatologie und Onkologie, ZKJ, Freiburg in dort etablierten Maus-Xenograft-Ewing-Sarkom-Modellen auf ihre Wirksamkeit hin untersucht werden (Dissertation Judith Jakoby).
Zytostatika-beladene Liposomen zur Behandlung des Neuroblastoms und der Leukämie
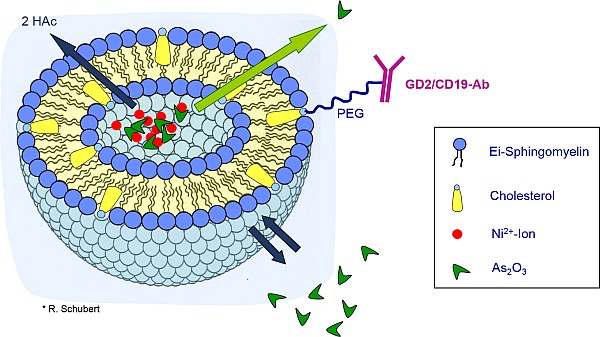
Im Rahmen einer Kooperationsarbeit mit Herrn Prof. Dr. Rupert Handgretinger (Kinderklinik Tübingen) wird an der stabilen Verkapselung von Arsentrioxid (ATO) in Liposomen gearbeitet. Hierzu wird Nickelacetat in den hydrophilen Kern rigider Liposomen aus Ei-Sphingomyelin verkapselt, welches zur Präzipitation eines Arsen-Nickelionen-Komplexes und damit zu einem stabilen Einschluss führt. Um eine lokale Akkumulation der Liposomen in der Tumorumgebung zu erzielen und damit die für eine effektive Therapie erforderlichen höheren Plasmaspiegelkonzentrationen zu umgehen (welche Nebenwirkungen wie Nieren- oder Herzversagen hervorrufen können), wird basierend auf vorangegangenen Doktorarbeiten des Lehrstuhls (Dr. Felicitas Lewrick) ein spezifisches Drug-Targeting angestrebt. Zu diesem Zweck wird die liposomale Oberfläche durch eine Ankerstruktur, die mit einem spezifischen Antikörper konjugiert ist, nach Präparation der Nickel/Arsen-haltigen Liposomen mit Hilfe der sogenannten Post-Insertions-Technik modifiziert.
Diese liposomale Präparation soll in der Behandlung solider Tumoren des Neuroblastoms zum Einsatz kommen (Dissertationen Ines Müller und Hannah Deibel). Hierfür wird die Oberflächenmodifikation mit einem Disialogangliosid 2 (GD2)-spezifischen Antikörper durchgeführt. Darauf aufbauend wird über die Modifikation mit einem CD19-spezifischen Antikörper an der Optimierung der liposomalen Präparation und an der Verkapselung weiterer Zytostatika für die Therapie der lymphatischen (prä-B-Zell-)Leukämie gearbeitet (Dissertation Kathrin Züfle).
Förderung
Das Projekt wird seit 2010 durch die Stiftung für Neuroblastomforschung e.V., Baden-Baden gefördert.
(Seitenmitte)
Liposom-Protamin-siRNA (LPR) Partikel zur Behandlung des Rhabdomyosarkoms
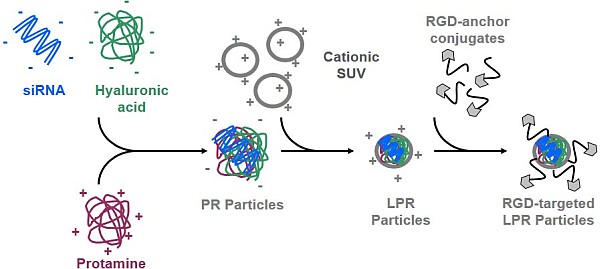
Das Alveoläre Rhabdomyosarkom (ARMS) gehört zu den häufigsten Weichteilsarkomen im Kindesalter und die etablierten Standardtherapien sind nur selten erfolgreich. Die Arbeitsgruppe von Prof. Dr. Regine Süss arbeitet in Kooperation mit der Arbeitsgruppe von Prof. Dr. Jochen Rößler vom Zentrum für Kinder- und Jugendmedizin des Universitätsklinikums Freiburg an der Erforschung eines neuen Therapieansatzes: Sequenzspezifische siRNA-Konstrukte sollen gezielt Strukturen des ARMS herunterregulieren und Onkogene hemmen. In Kombination mit geeigneten Transportsystemen sollen intrazelluläre Aufnahme, Verteilung und Verfügbarkeit der siRNA verbessert werden. Mit dieser Zielsetzung wurden Liposom-Protamin-siRNA (LPR) Formulierungen entwickelt und erfolgreich in Zellversuchen evaluiert. Eine zusätzliche Modifizierung der Partikel mit Antikörpern und Peptiden gegen ARMS-Oberflächenstrukturen soll ein gezieltes Ansteuern der Tumoren in vivo ermöglichen (Dissertation Doris Zimmer).
Förderung
Das Projekt wurde von 2009 bis 2011 durch die DFG gefördert.
Liposomen mit Bor-haltigen Lipiden zur Neutroneneinfang-Therapie
Im Rahmen der Bor-Neutroneneinfangtherapie (Boron Neutron Capture Therapy; BNCT) maligner Tumoren werden 10Bor-haltige Moleküle in räumlicher Nähe zu Tumorzellen mit thermischen Neutronen bestrahlt. Die Aufnahme eines Neutrons in den 10Bor-Kern bewirkt eine Kernreaktion unter Bildung des instabilen 11Bor-Kerns und dessen Zerfall in 7Lithium und ein α-Teilchen. Diese Teilchen schädigen Zellgewebe in einer Reichweite von ca. 10 µm, was etwa dem Durchmesser einer Zelle entspricht. Idealerweise sind weder die Neutronenstrahlung noch die verwendeten Bor-haltigen Moleküle für sich allein toxisch für den Organismus, so dass Nebenwirkungen nicht zu befürchten sind. Problematisch hierbei ist allerdings das Erreichen wirksamer 10Bor-Spiegel im Zielgewebe. Aus diesem Grund beabsichtigen wir, hierfür Liposomen als geeignete Carrier-Systeme einzusetzen.
In Kooperation mit der Arbeitsgruppe von Prof. Dr. Detlef Gabel an der Universität Bremen werden neuartige Bor-haltige Lipidstrukturen synthetisiert und in Liposomenmembranen eingebaut. Diese Präparate werden auf ihre Stabilität, Zellaufnahme, Einfluss auf die zelluläre Vitalität und andere Parameter hin untersucht (Dissertation Alexander Burghardt).
Förderung
Dieses Projekt wird seit 2007 von der DFG gefördert.
Schaffran T, Lissel F, Samatanga B, Karlsson G, Burghardt A, Edwards K, Winterhalter M, Peschka-Süss R, Schubert R, Gabel D: Dodecaborate cluster lipids with variable headgroups for boron neutron capture therapy: Synthesis, physical-chemical properties and toxicity, J. Organomet. Chem. 694, 1708-1712, 2009. [zum Originalartikel]